Contents
Les électrolytes forts sont complètement dissociés en ions dans l’eau. La molécule d’acide ou de base n’existe pas en solution aqueuse, seulement des ions. Les électrolytes faibles ne sont pas complètement dissociés. Voici des définitions et des exemples d’acides forts et faibles et de bases fortes et faibles.
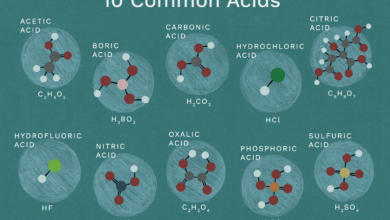
Acides forts
Les acides forts se dissocient complètement dans l’eau, formant H+ et un anion. Il existe six acides forts. Les autres sont considérés comme des acides faibles. Vous devez garder en mémoire les acides forts :
- HCl : acide chlorhydrique
- HNO3 : acide nitrique
- H2SO4 : acide sulfurique
- HBr : acide bromhydrique
- HI : acide hydroiodique
- HClO4 : acide perchlorique
Si l’acide est dissocié à 100 % dans des solutions de 1,0 M ou moins, il est dit fort. L’acide sulfurique n’est considéré comme fort que dans sa première étape de dissociation ; une dissociation à 100 % n’est pas vraie lorsque les solutions deviennent plus concentrées.
H2SO4 → H+ + HSO4-
Acides faibles
Un acide faible ne se dissocie que partiellement dans l’eau pour donner H+ et l’anion. L’acide fluorhydrique, HF, et l’acide acétique, CH3COOH, sont des exemples d’acides faibles. Les acides faibles comprennent :
- Molécules qui contiennent un proton ionisable. Une molécule dont la formule commence par H est généralement un acide.
- Acides organiques contenant un ou plusieurs groupes carboxyle, -COOH. Le H est ionisable.
- Anions avec un proton ionisable (par exemple, HSO4- → H+ + SO42-).
- Cations
- Les cations des métaux de transition
- Cations de métaux lourds à forte charge
- Le NH4+ se dissocie en NH3 + H+
Des bases solides
Les bases fortes se dissocient à 100 % en cation et en OH- (ion hydroxyde). Les hydroxydes des métaux du groupe I et du groupe II sont généralement considérés comme des bases fortes.
- LiOH : hydroxyde de lithium
- NaOH : hydroxyde de sodium
- KOH : hydroxyde de potassium
- RbOH : hydroxyde de rubidium
- CsOH : hydroxyde de césium
- *Ca(OH)2 : hydroxyde de calcium
- *Sr(OH)2 : hydroxyde de strontium
- *Ba(OH)2 : hydroxyde de baryum
* Ces bases se dissocient complètement dans les solutions de 0,01 M ou moins. Les autres bases forment des solutions de 1,0 M et se dissocient à 100 % à cette concentration. Il existe d’autres bases fortes que celles énumérées, mais elles ne sont pas souvent rencontrées.
Bases faibles
Les exemples de bases faibles comprennent l’ammoniac, le NH3, et la diéthylamine, (CH3CH2)2NH. Comme les acides faibles, les bases faibles ne se dissocient pas complètement en solution aqueuse.
- La plupart des bases faibles sont des anions d’acides faibles.
- Les bases faibles ne fournissent pas d’ions OH- par dissociation. Au contraire, elles réagissent avec l’eau pour générer des ions OH-.