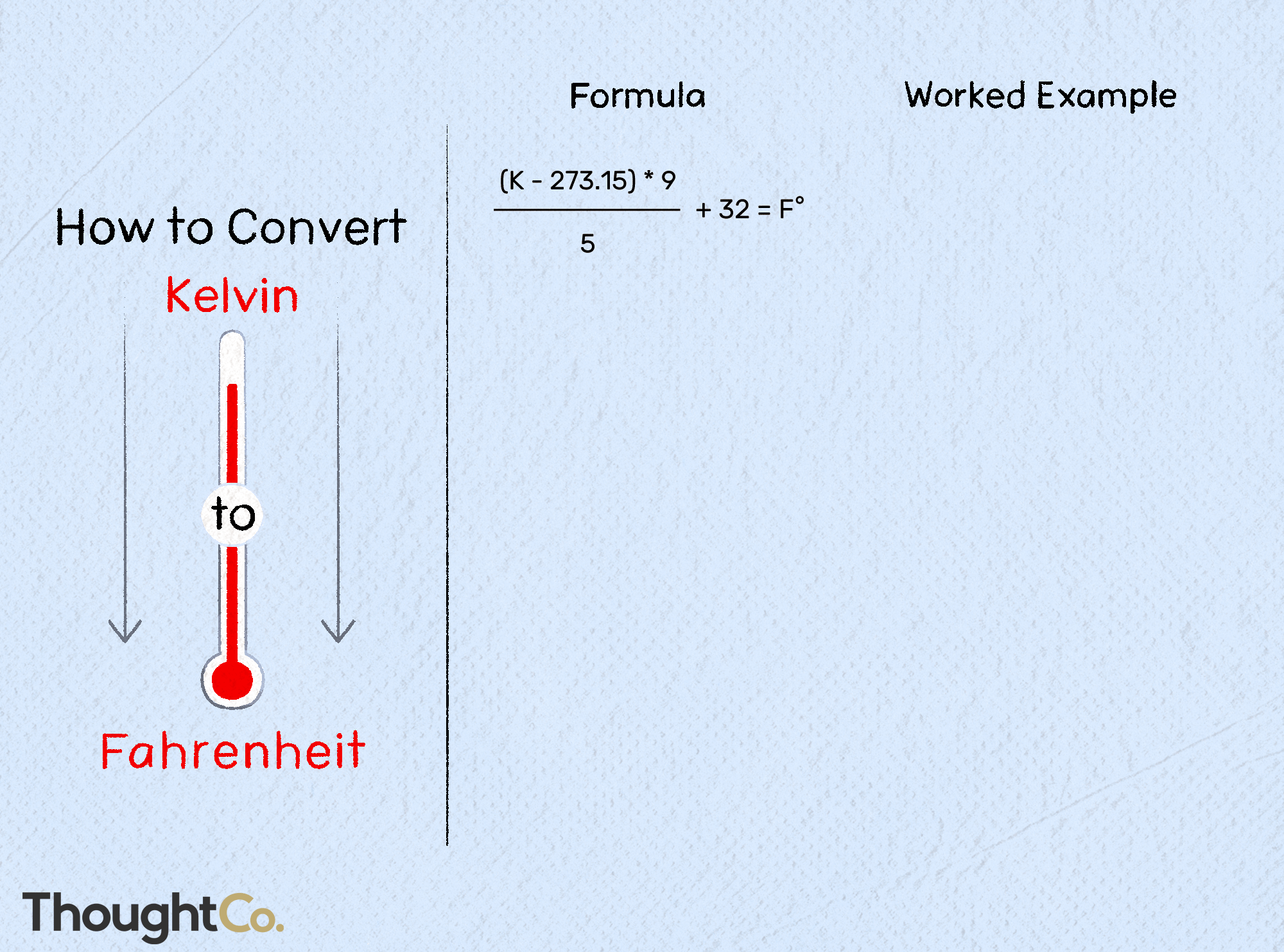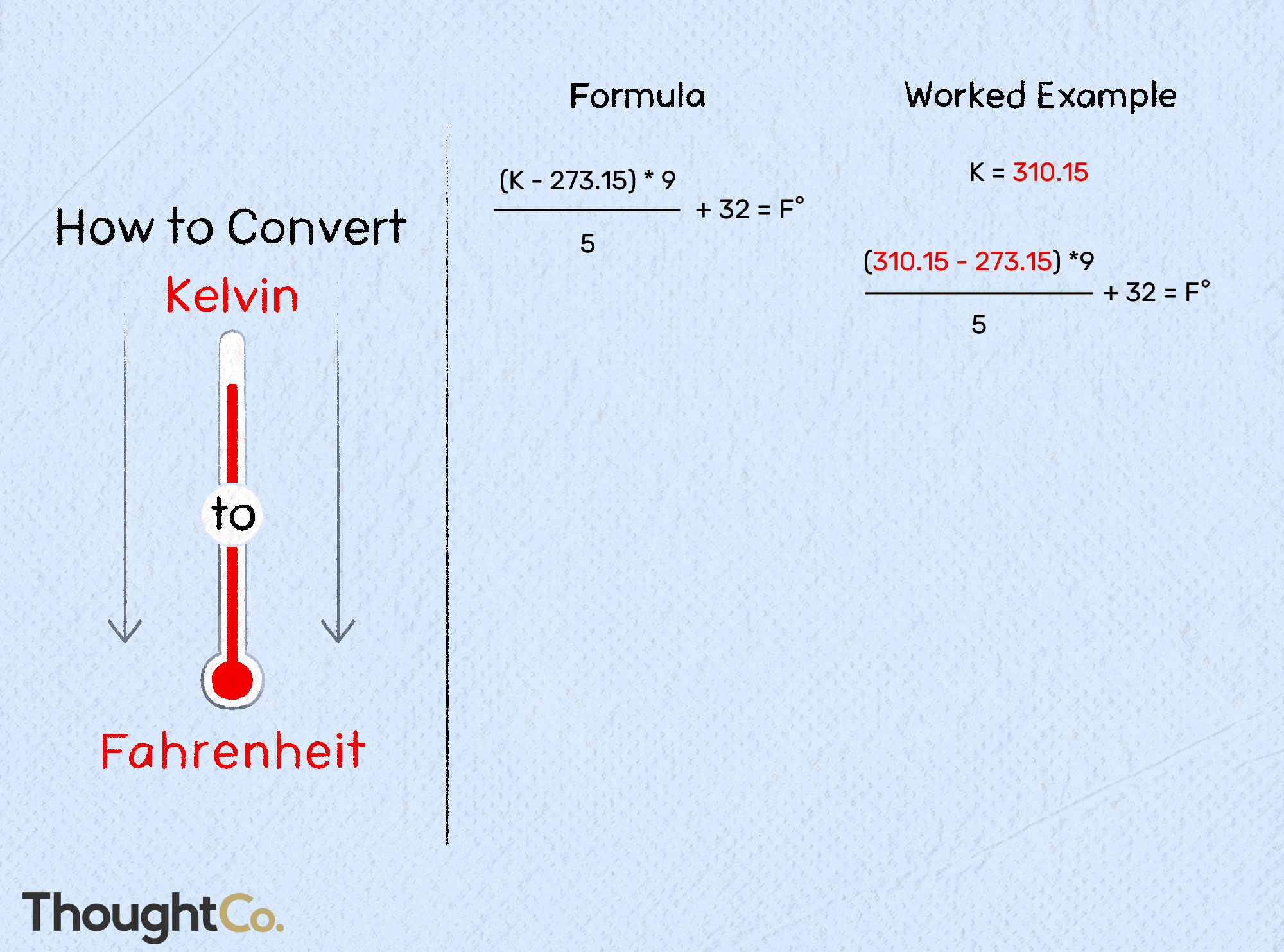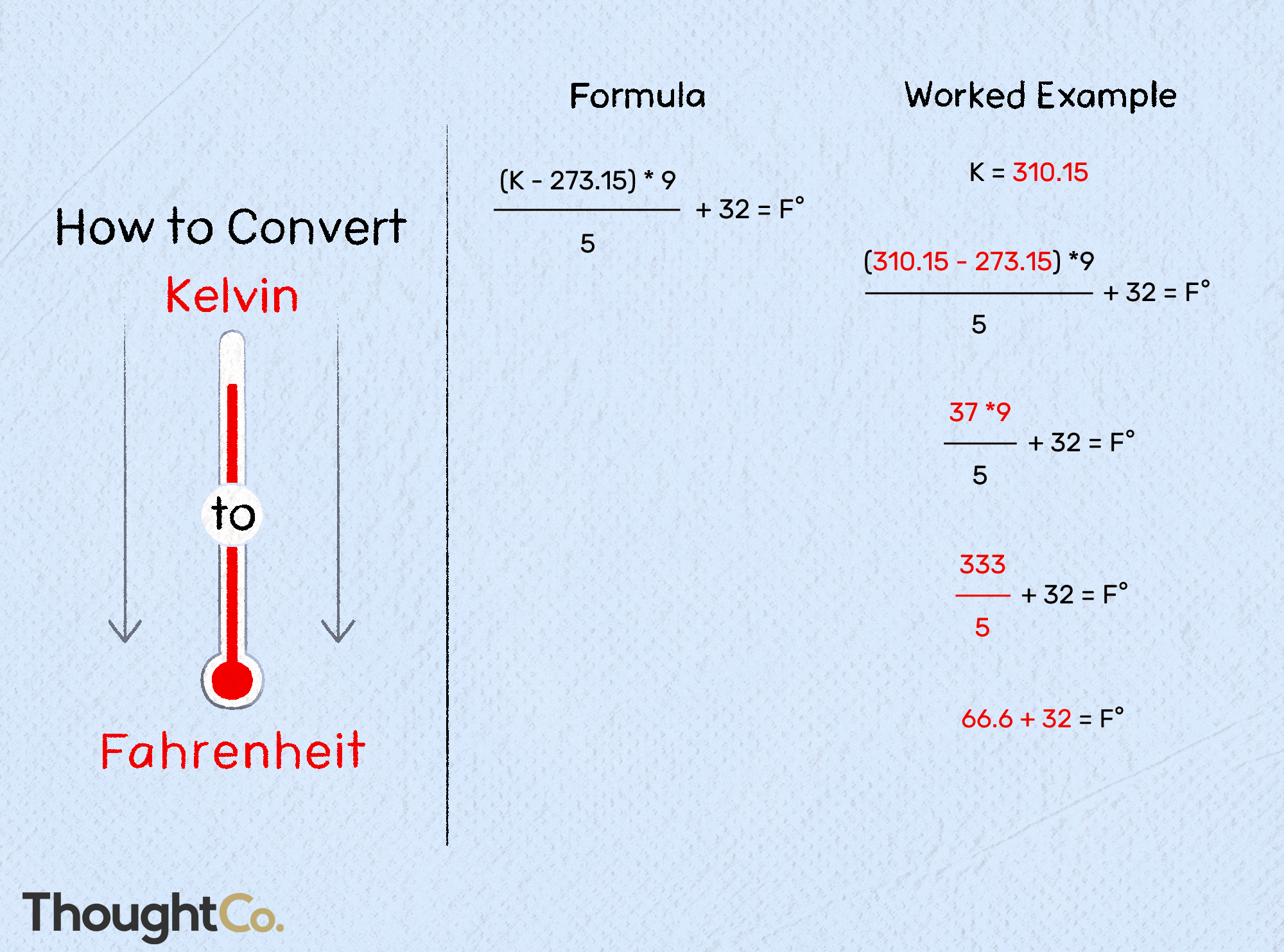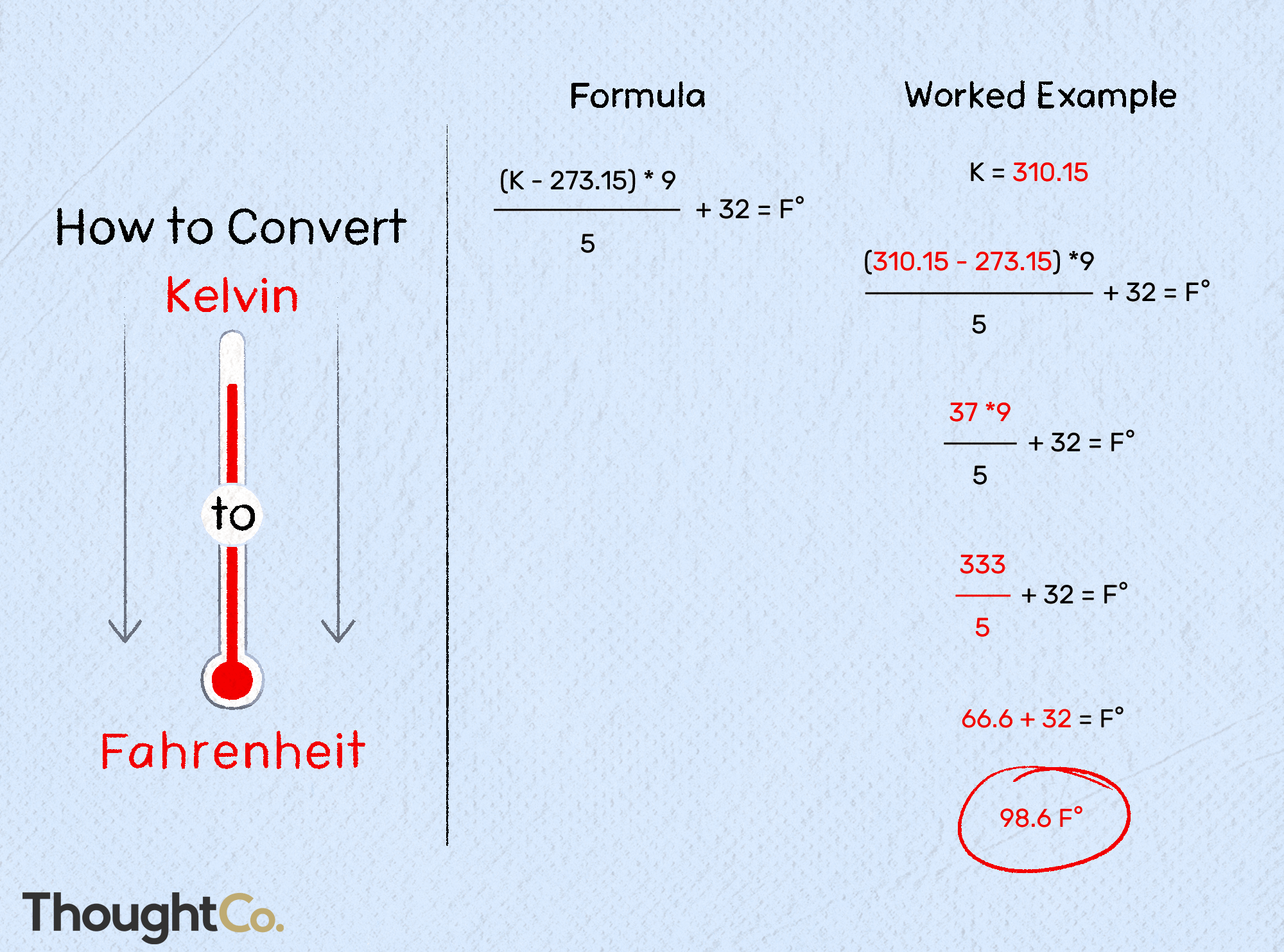
Contents
Le réactif limite d’une réaction est celui qui s’épuiserait en premier si tous les réactifs réagissaient ensemble. Une fois que le réactif limitant est complètement consommé, la réaction cesserait de progresser. Le rendement théorique d’une réaction est la quantité de produits fabriqués lorsque le réactif limitant s’épuise. Cet exemple travaillé de problème de chimie montre comment déterminer le réactif limitant et calculer le rendement théorique d’une réaction chimique.
Limiter le problème du rendement théorique et réactif
Vous obtenez la réaction suivante :
2 H2(g) + O2(g) → 2 H2O(l)
Calculer :
a. le rapport stoechiométrique des moles de H2 aux moles de O2b. les moles réelles de H2 aux moles de O2 lorsque 1,50 mole de H2 est mélangée à 1,00 mole de O2c. le réactif limiteur (H2 ou O2) pour le mélange de la partie (b)d. le rendement théorique, en moles, de H2O pour le mélange de la partie (b)
Solution
a. Le rapport stoechiométrique est donné en utilisant les coefficients de l’équation équilibrée. Les coefficients sont les nombres indiqués avant chaque formule. Cette équation est déjà équilibrée, alors reportez-vous au tutoriel sur les équations équilibrées si vous avez besoin d’aide supplémentaire :
2 mol H2 / mol O2
b. Le ratio réel se réfère au nombre de taupes effectivement fournies pour la réaction. Ce nombre peut être identique ou non au rapport stoechiométrique. Dans ce cas, il est différent :
1,50 mol H2 / 1,00 mol O2 = 1,50 mol H2 / mol O2
c. Notez que le rapport réel est inférieur au rapport requis ou stoechiométrique, ce qui signifie qu’il n’y a pas assez d’H2 pour réagir avec tout l’O2 qui a été fourni. Le composant « insuffisant » (H2) est le réactif limitant. Une autre façon de le dire est de dire que l’O2 est en excès. Lorsque la réaction est terminée, tout l’H2 a été consommé, laissant un peu d’O2 et le produit, H2O.
d. Le rendement théorique est basé sur le calcul utilisant la quantité de réactif limite, 1,50 mol H2. Étant donné que 2 mol H2 forment 2 mol H2O, on obtient
rendement théorique H2O = 1,50 mol H2 x 2 mol H2O / 2 mol H2
rendement théorique H2O = 1,50 mol H2O
Notez que la seule exigence pour effectuer ce calcul est de connaître la quantité de réactif limitant et le rapport entre la quantité de réactif limitant et la quantité de produit.
Réponses
a. 2 mol H2 / mol O2b. 1,50 mol H2 / mol O2c. H2d. 1,50 mol H2O
Conseils pour travailler sur ce type de problème
- Le point le plus important à retenir est qu’il s’agit du rapport molaire entre les réactifs et les produits. Si l’on vous donne une valeur en grammes, vous devez la convertir en moles. Si on vous demande de fournir un chiffre en grammes, vous devez le convertir en moles.
- Le réactif limitant n’est pas automatiquement celui qui a le plus petit nombre de taupes. Par exemple, disons que vous avez 1,0 mole d’hydrogène et 0,9 mole d’oxygène dans la réaction pour produire de l’eau. Si vous ne tenez pas compte du rapport stoechiométrique entre les réactifs, vous pourriez choisir l’oxygène comme réactif limitant, mais l’hydrogène et l’oxygène réagissent dans un rapport de 2:1, ce qui fait que l’hydrogène est consommé beaucoup plus tôt que l’oxygène.
- Lorsqu’on vous demande de donner des quantités, surveillez le nombre de chiffres significatifs. Ils ont toujours de l’importance en chimie !